Kinetika kimia adalah suatu ilmu yang membahas tentang laju (kecepatan) dan
mekanisme reaksi. Berdasarkan penelitianyang mula – mula dilakukan oleh
Wilhelmy terhadap kecepatan inversi sukrosa, ternyata kecepatan reaksi
berbanding lurus dengan konsentrasi / tekanan zat – zat yang bereaksi. Laju reaksi dinyatakan
sebagai perubahan konsentrasi atau tekanan dari produk atau reaktan terhadap
waktu.
Berdasarkan
jumlah molekul yang bereaksi, reaksi terdiri atas :
1.
Reaksi unimolekular : hanya 1 mol
reaktan yang bereaksi
Contoh
: N2O5 à N2O4 + ½ O2
2.
Reaksi bimolekular : ada 2 mol reaktan
yang bereaksi
Contoh
: 2 HI
à H2
+ I2
3.
Reaksi termolekular : ada 3 mol reaktan
yang bereaksi
Contoh
: 2 NO
+ O2 à 2NO2
Berdasarkan
banyaknya fasa yang terlibat, reaksi terbagi menjadi :
1.
Reaksi homogen : hanya terdapat satu
fasa dalam reaksi (gas atau larutan)
2.
Reaksi heterogen : terdapat lebih dari
satu fasa dalam reaksi
Secara
kuantitatif, kecepatan reaksi kimia ditentukan oleh orde reaksi, yaitu jumlah
dari eksponen konsentrasi pada persamaan kecepatan reaksi.
1 Reaksi Orde Nol
Pada
reaksi orde nol, kecepatan reaksi tidak tergantung pada konsentrasi reaktan.
Persamaan
laju reaksi orde nol dinyatakan sebagai :
- dA/dt = k0
A - A0 = - k0 . t
A = konsentrasi zat pada waktu t
A0 =
konsentrasi zat mula – mula
Reaksi Orde Satu
Pada
reaksi prde satu, kecepatan reaksi berbanding lurus dengan konsentrasi reaktan.
Persamaan
laju reaksi orde satu dinyatakan sebagai :
- dA/dt = k1 [A]
- dA/(A) = k1 dt
ln (Ao)/ (A)= k1 (t – t0)
Bila t = 0 à A = A0
ln
[A] =
ln [A0] - k1 t
[A]
= [A0] e-k1t
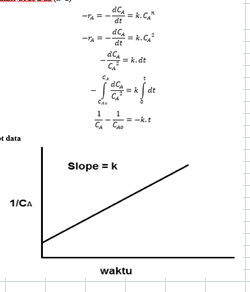
Reaksi
Orde Dua


No comments:
Post a Comment